光学活性的环丙胺是众多具有生物活性的天然产物、药物和农药的基本结构单元。为此,人们发展了不同种类的不对称合成方法,传统方法主要包括烯胺类化合物的 [2+1] 反应和环丙烯的氢(碳)胺化反应。这些底物的反应位点通常需要进行预活化,从而增加冗余的合成步骤和额外的试剂。因此,发展原子和步骤经济的催化不对称方法是该领域亟待解决的问题。
中国科学院兰州化学物理研究所羰基合成与选择氧化国家重点实验室徐森苗团队(有机硼催化组)一直致力于过渡金属催化的区域和立体选择性碳氢键硼化反应。该团队通过发展一类新型的手性双齿硼基配体(CBL),实现了过渡金属铱催化的配位基团导向的二芳基甲基胺的C(sp2)-H键 (J. Am. Chem. Soc. 2019, 141, 5334)、环丙烷甲酰胺的C(sp3)-H键 (J. Am. Chem. Soc. 2019, 141, 10599)、环丁烷的C(sp3)-H键的不对称硼化 (Chin. J. Chem. 2020, 38, 1533),环状胺类化合物的α-C(sp3)-H键 (J. Am. Chem. Soc. 2020, 142, 12062)、非活化亚甲基的C(sp3)-H键(Angew. Chem. Int. Ed. 2021, 60, 3524; Angew. Chem. Int. Ed. 2021, 61, 5843)、二芳基次膦酸酯的C(sp2)-H键 (ACS Catal. 2021, 11, 13445) 和二茂铁的C(sp2)-H键 (ACS Catal. 2022, 12, 1830) 的不对称硼化反应。
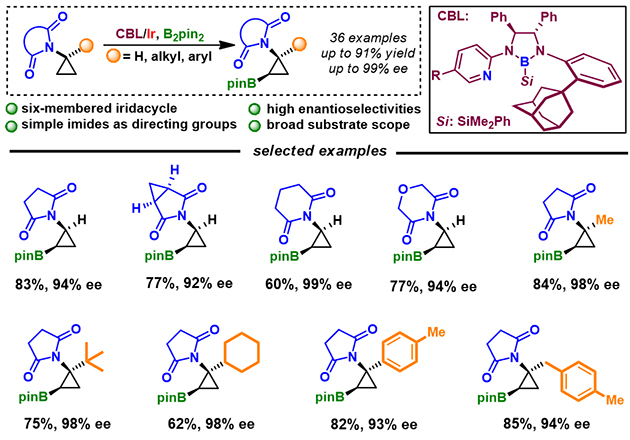
图一 CBL/Ir催化的环丙胺类化合物的不对称C(sp3)-H键硼化反应
最近,该团队针对环丙胺碳氢活化中缺乏合适导向基、易开环、存在竞争性反应等问题,利用金刚烷取代的CBL,首次实现了以简单环状酰亚胺为导向基,环丙胺类化合物的高对映选择性C(sp3)-H键硼化反应,产物的最高ee值可达99% (图一)。该反应具有非常广谱的底物兼容性(36个例子),所获得的硼化产物可发生一系列的转化反应,并可实现生物活性分子的合成。
相关成果在线发表在德国应用化学(Angew. Chem. Int. Ed.) (论文链接:https://onlinelibrary.wiley.com/doi/epdf/10.1002/anie.202201463)。
以上工作得到了国家自然科学基金、江苏省自然科学基金、兰州化物所、羰基合成与选择氧化国家重点实验室和杭州师范大学有机硅化学及材料技术教育部重点实验室的支持。(来源:中国科学院兰州化学物理研究所)
相关论文信息:https://doi.org/10.1002/anie.202201463
原文链接:https://news.sciencenet.cn/htmlpaper/2022/2/20222251682315970424.shtm