手性与生命现象密切相关,也显著影响物质的性能。人类对于光学活性物质的需求促成手性化合物的研究与开发的快速进步,不对称催化由于其手性增殖(即每个手性催化剂分子可生产增殖很多的手性产物分子)的突出优势而特别引人注目。目前不对称催化合成手性功能分子和材料是催化化学研究的前沿课题之一。
中国科学院兰州化学物理研究所羰基合成与选择氧化国家重点实验室有机功能材料组致力于碳水化合物和天然有机酸衍生的新型手性亚磷酸酯配体合成及其在不对称催化反应中的应用研究。近期,研究人员发明了一种钯/亚磷酸酯配体催化不对称烯丙基烷基化反应的方法,获得国家发明专利授权,专利号:ZL201410450880.2。
碳水化合物和天然有机酸来源广泛、光学纯度高,具有手性结构的碳骨架和可进行多重化学修饰的功能基团,通过化学修饰易于获得特定结构的化合物,继而作为重要的手性单元被广泛应用于手性亚磷酸酯配体合成。该研究组合成系列基于碳水化合物和天然有机酸的新型手性亚磷酸酯配体,这些配体与过渡金属络合制备的手性催化剂,被成功应用于不对称1,4-共轭加成反应、不对称氢甲酰化反应、不对称氢化、不对称烯丙基烷基化,催化活性和对映选择性高,充分显示其在金属催化的不对称反应中的巨大潜力。
合成的手性亚磷酸酯配体性质稳定,易于保存,对反应底物的适应范围广,可催化多种反应类型,且反应条件温和,反应易于操作。
采用碳水化合物如葡萄糖苷、甘露醇衍生物和联萘酚为起始原料,设计合成系列手性亚磷酸酯配体,在铜催化有机锌对烯酮的不对称1, 4-共轭加成反应中可获得高活性和高对映选择性(如图式1所示);在铑催化的不对称氢甲酰化反应中可获得高活性和中等的对映选择性,合成具有光学活性的酮或醛含羰基化合物。采用天然有机酸L-酒石酸衍生的亚磷酸酯配体,制备铜手性络合物,分别应用于有机锌试剂对底物2-环戊烯酮和2-环己烯酮的1,4-共轭加成反应中,均可获得高活性和高达95%的对映选择性。
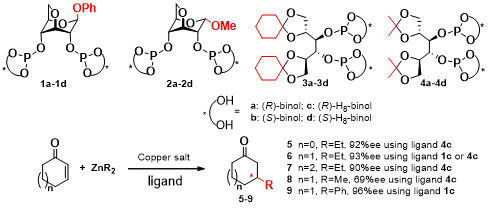
图式1. 碳水化合物衍生的手性亚磷酸酯配体及在铜催化有机锌对烯酮的不对称1, 4-共轭加成反应中的应用。
采用葡萄糖苷型亚磷酸酯配体原位制备的铑手性络合物,在较温和的反应条件下,以功能化烯烃为底物,在不对称氢化反应中可获得高达98%对映选择性(如图式1和2所示)。

图式2. 葡萄糖苷型双齿亚磷酸酯配体在功能化烯烃的不对称氢化反应中应用。
该研究组部分基础研究结果相继发表在:Adv. Synth. Catal., 2004, 346, 947-953; Tetrahedron,2013, 69, 455-459;2014, 70, 8822-8828;Tetrahedron: Asymmetry, 2007, 18, 1899-1905; 2011, 22, 1885-1890; 2017, 28, 330-335;Catal Lett, 2017,147,893-899。
以上工作得到国家自然科学基金、中国科学院、兰州化物所和羰基合成与选择氧化国家重点实验室的支持。